申请提交后,我们将在24小时内联系您。
请放心填写您的个人信息,该信息仅用于“摩熵医药企业版”的试用申请。
提交申请即默认注册摩熵医药企业版账号,申请通过后可使用此手机号登录试用。
购买咨询:400-9696-311转1
申请提交后,我们将在24小时内联系您。
请放心填写您的个人信息,该信息仅用于“摩熵医药企业版”的试用申请。
提交申请即默认注册摩熵医药企业版账号,申请通过后可使用此手机号登录试用。
购买咨询:400-9696-311转1
您的试用申请已提交,我们将在24小时内与您联系
您的试用申请已提交,我们将在24小时内与您联系


7天免费试用

7天免费试用

美国FDA批准药品数据库操作手册
本文目录:
一、数据库价值&特色
1. 数据库简介
2. 数据库价值
3. 受众人群
二、数据库入口
1. 数据库入口
2. 申请试用入口
三、使用场景示例
1、 查询Ibalizumab(艾巴利珠单抗)批准的处方使用情况
2、 检索江苏恒瑞医药在美国FDA批准上市的药物情况
3、 查询中国企业2017-2024年期间在FDA批准上市的新药情况
4、 查询FDA历年批准的Type 1新分子实体,分析其申报企业、活性成分
四、联系我们
一、数据库价值&特色
1.数据库简介
美国FDA批准药品数据库,收载了1939年至今美国FDA批准在美国上市、暂定批准的4万+药品信息。可查询药品审批注册信息、药品说明书及相关批准文件等。药物信息主要包括:商品名、申请机构、申请号、活性成分、剂型给药途径、是否参比制剂、是否生物等效试验对照药品、治疗等效代码、药品提交类型(新药化学类别)和审评类别、审批历史信息等。 数据库实时更新,提供多维度检索,帮助用户快速查询最新批准药品以及目标产品在美国审批注册信息、药品说明书等重要信息。
2.数据库价值
Ø 便于用户了解最新批准药品信息,掌握国内外进展
Ø 便于查找原研药品、仿制药或者参比制剂信息,是药品研发、立项重要参考信息
Ø 通过药物审批文件和标签信息,帮助用户了解FDA药物的审评信息
3.受众人群
立项调研、药物研发、注册、医药投资、BD部门等。
二、数据库入口
1. 数据库入口
操作路径:顶部菜单栏选择【全球上市】数据库群中的【美国FDA批准药品】数据库,然后点击进入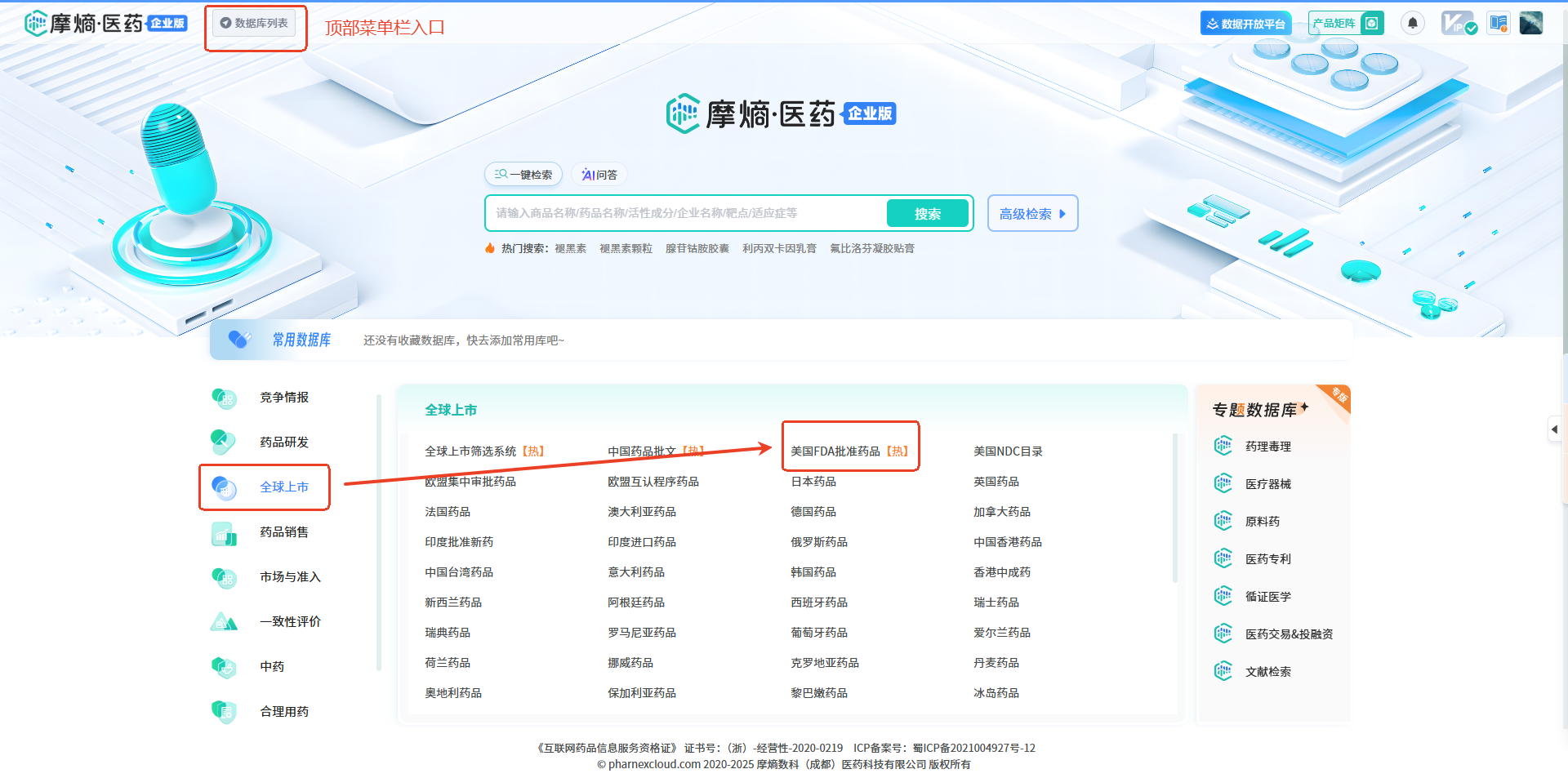 2. 申请试用入口
2. 申请试用入口
https://vip.pharnexcloud.com/?auto=1
三、使用场景示例
1.查询Ibalizumab(艾巴利珠单抗)批准的处方使用情况
操作路径:【药品名称】输入【Ibalizumab】然后点击【搜索】,在查询结果中就可以看到其申报企业、申报号、活性成分、规格、剂型、说明书等批准数据,点击绿色的药品名称,即可查看Ibalizumab(艾巴利珠单抗)批准的详细信息;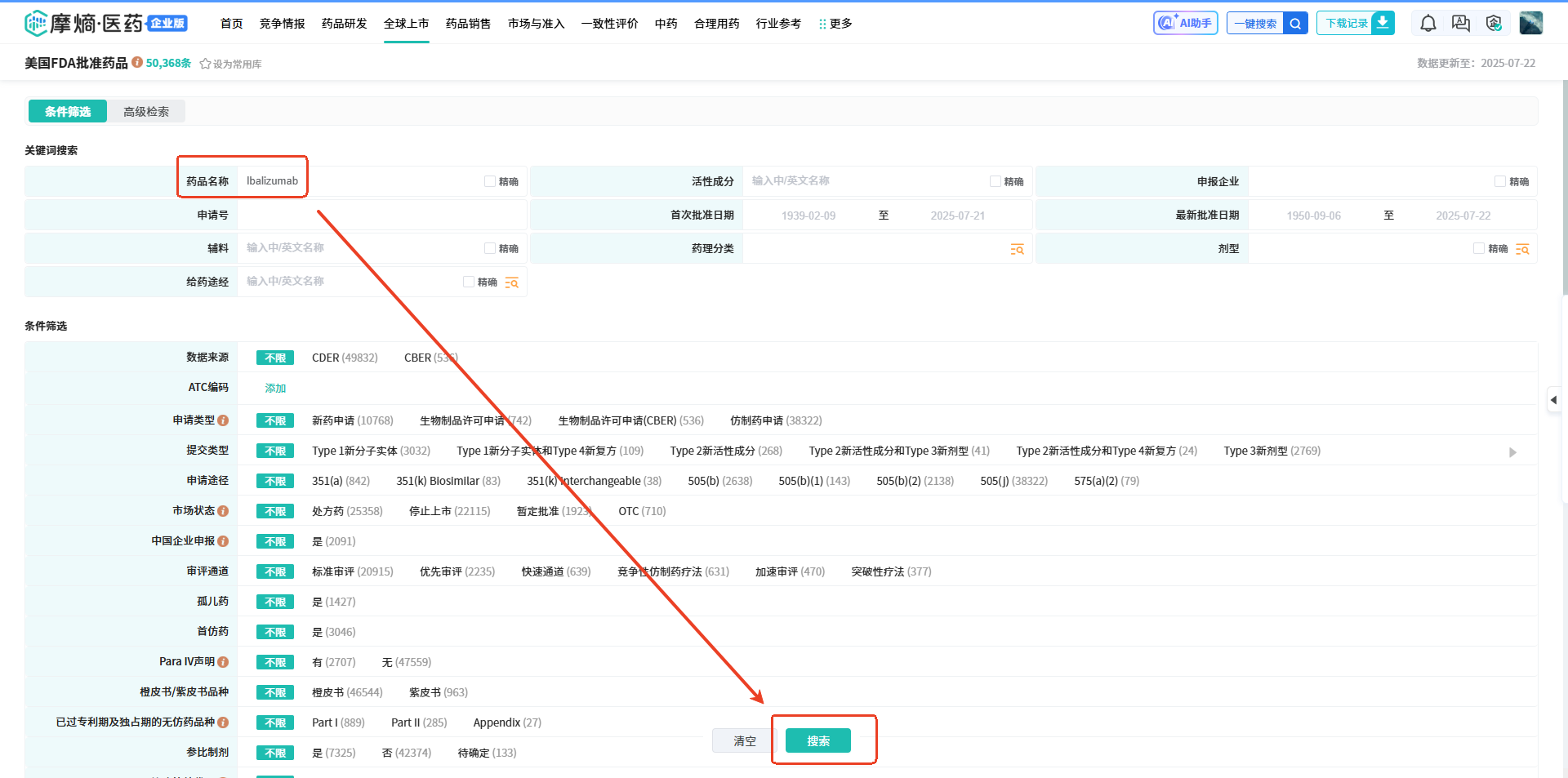
 进入到药品详情页,在【临床试验结果】中,可以看到Ibalizumab(艾巴利珠单抗)批准的处方使用情况。
进入到药品详情页,在【临床试验结果】中,可以看到Ibalizumab(艾巴利珠单抗)批准的处方使用情况。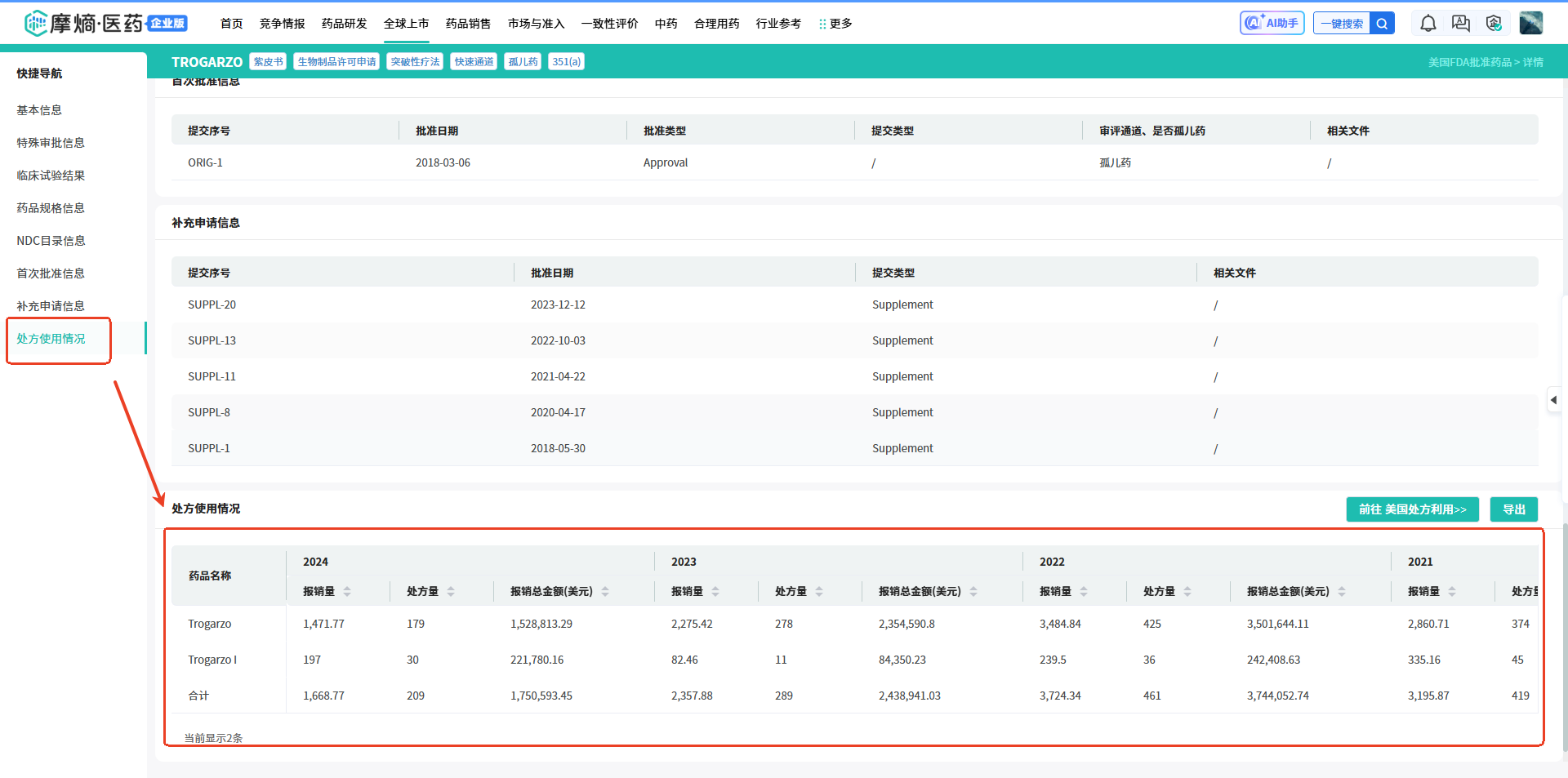 2.检索江苏恒瑞医药在美国FDA批准上市的药物情况
2.检索江苏恒瑞医药在美国FDA批准上市的药物情况
操作路径:【申报企业】输入【江苏恒瑞或者JIANGSU HENGRUI MED】然后点击【搜索】,可以看到江苏恒瑞医药在美国FDA批准上市的药物情况。点击相应的绿色【药品名称】,可以详细查看药品信息,包括基本信息、药品规格信息、首次批准信息、关联信息等等。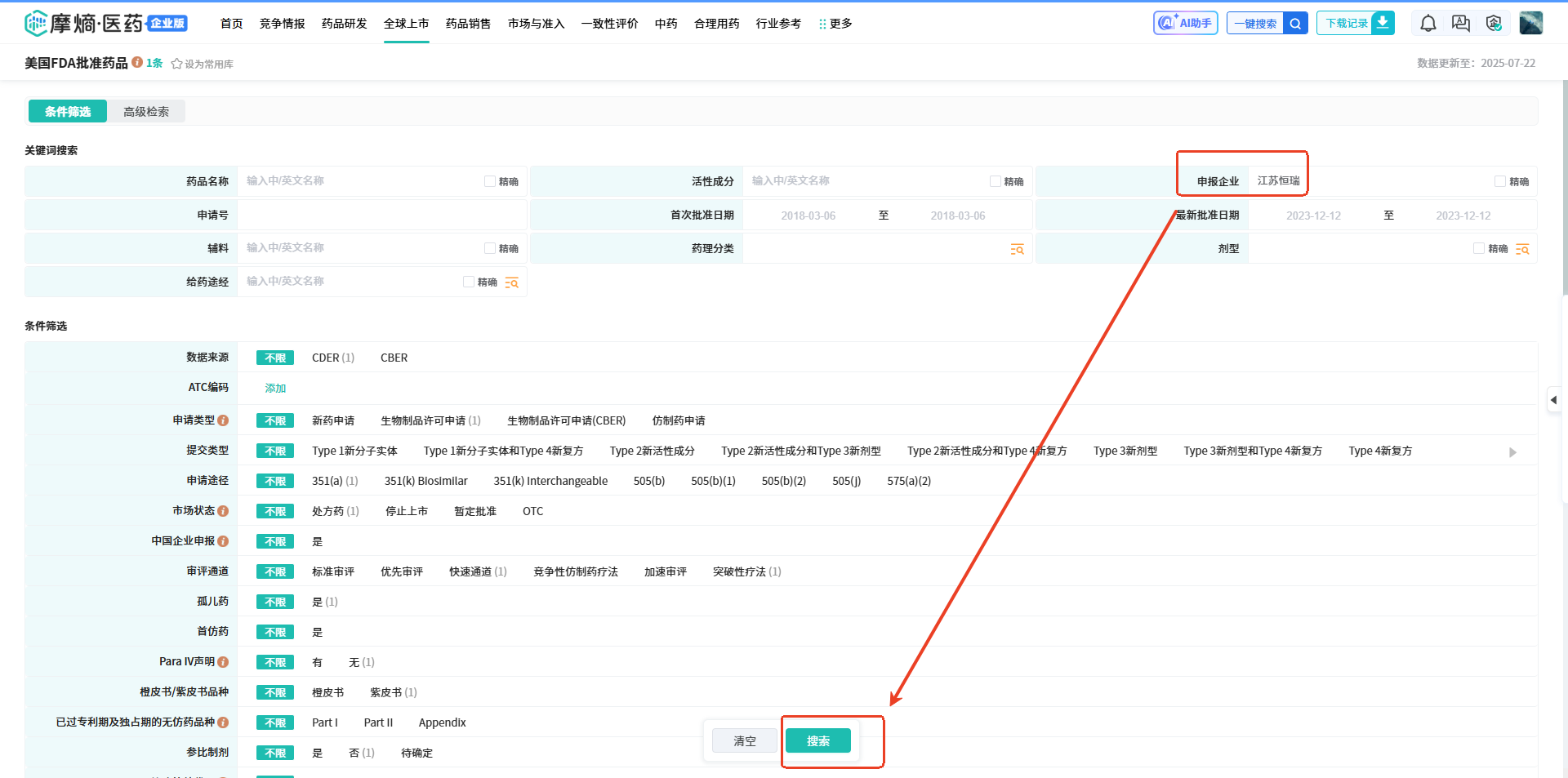

 点击【全局分析】,可以选择不同分析维度进行分类分析。
点击【全局分析】,可以选择不同分析维度进行分类分析。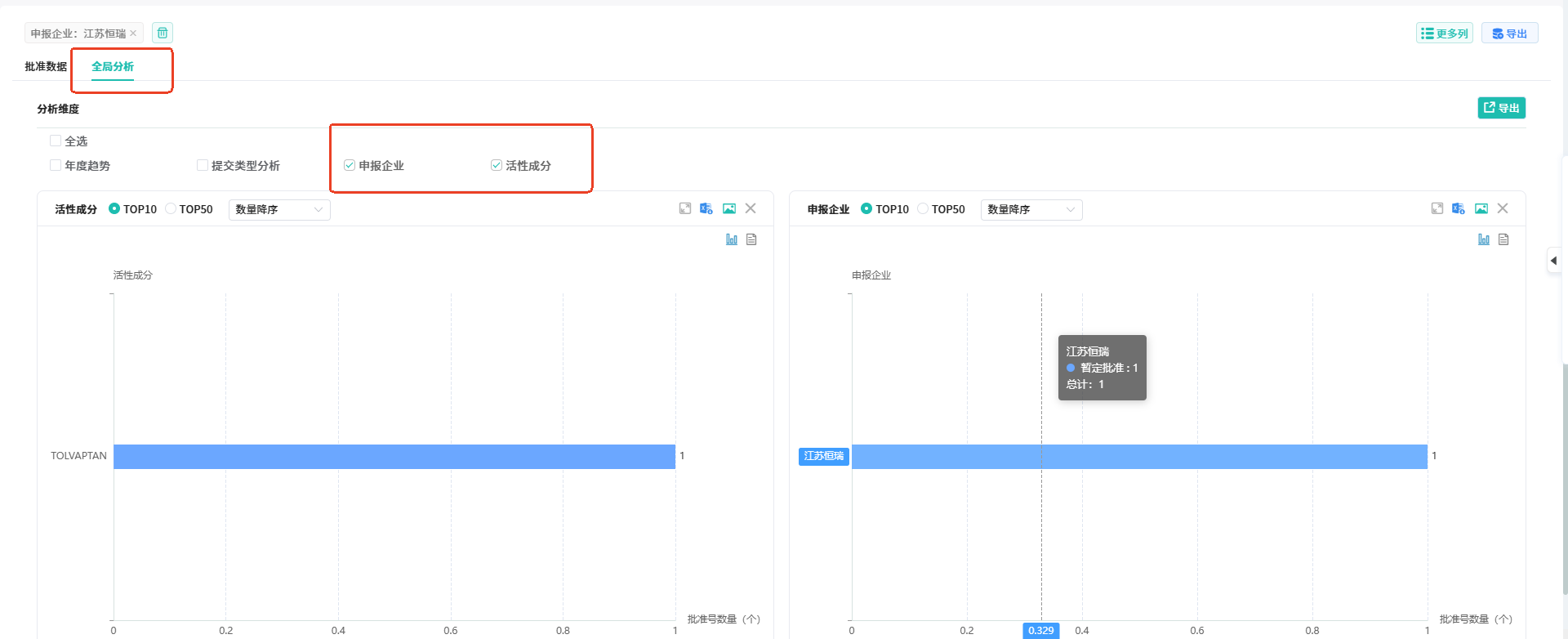 3. 查询全球企业2017-2024年期间在FDA批准上市的新药情况
3. 查询全球企业2017-2024年期间在FDA批准上市的新药情况
操作路径:【首次批准日期】选择【2017-1-1至2024-12-31】,【申请类型】选择【新药申请】,然后点击【搜索】,可以得到查询结果共有14条。在条件筛选项中,还能看到相对应的提交类型、申请途径、市场状态、审评通道、参比制剂等信息;以及可以对查询结果按申请号、活性成分、申报企业进行分类浏览。
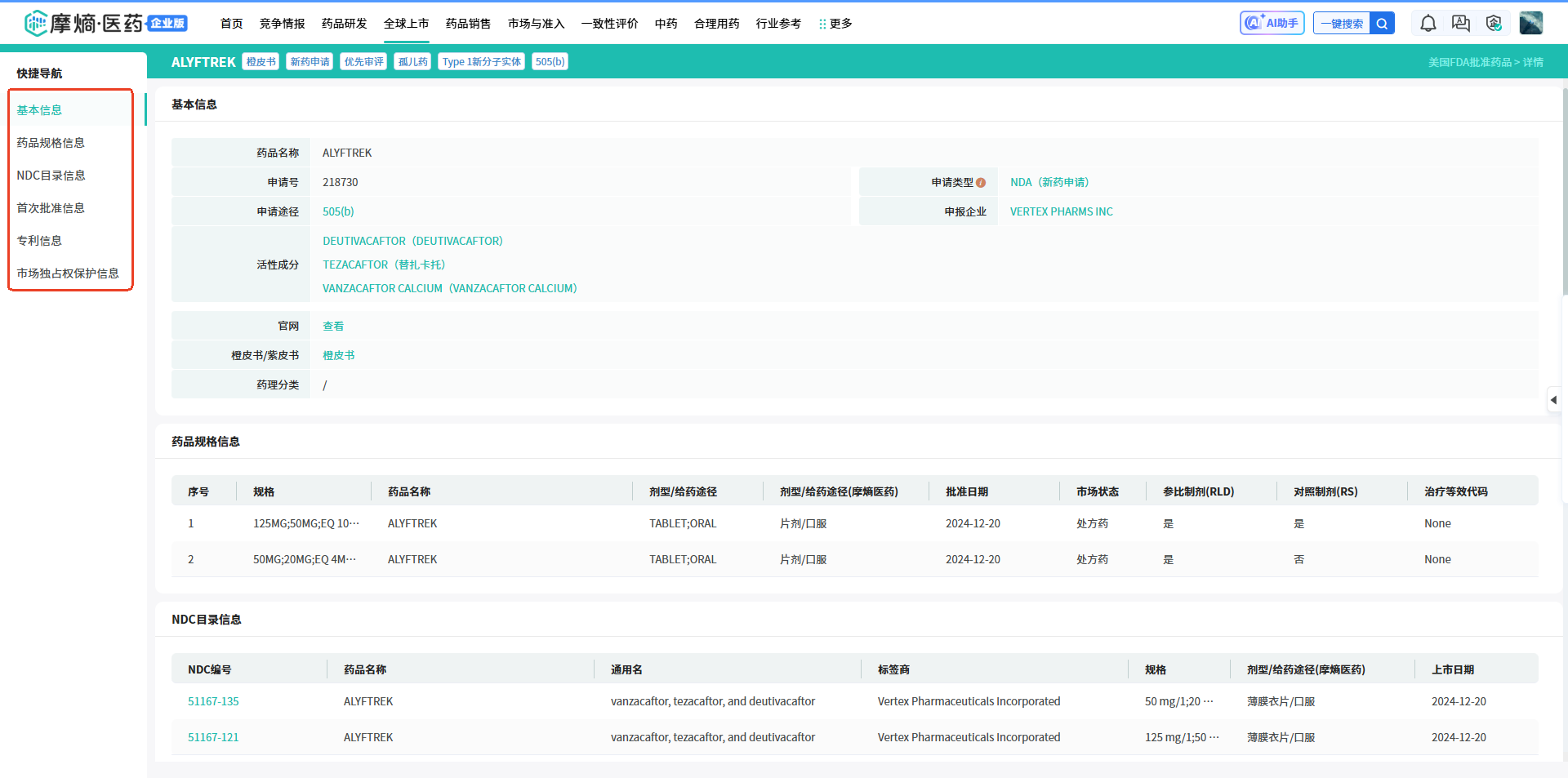
 (1)我们可以看到,全球企业2017-2024年期间在FDA批准上市的新药有1753款,筛选项【孤儿药】中选择【是】,可以看到ALYFTREK是一款孤儿药,进入详情页,可查看其临床试验结果、药品规格信息、NDC目录信息、首次批准信息、专利信息、市场独占权保护信息等。
(1)我们可以看到,全球企业2017-2024年期间在FDA批准上市的新药有1753款,筛选项【孤儿药】中选择【是】,可以看到ALYFTREK是一款孤儿药,进入详情页,可查看其临床试验结果、药品规格信息、NDC目录信息、首次批准信息、专利信息、市场独占权保护信息等。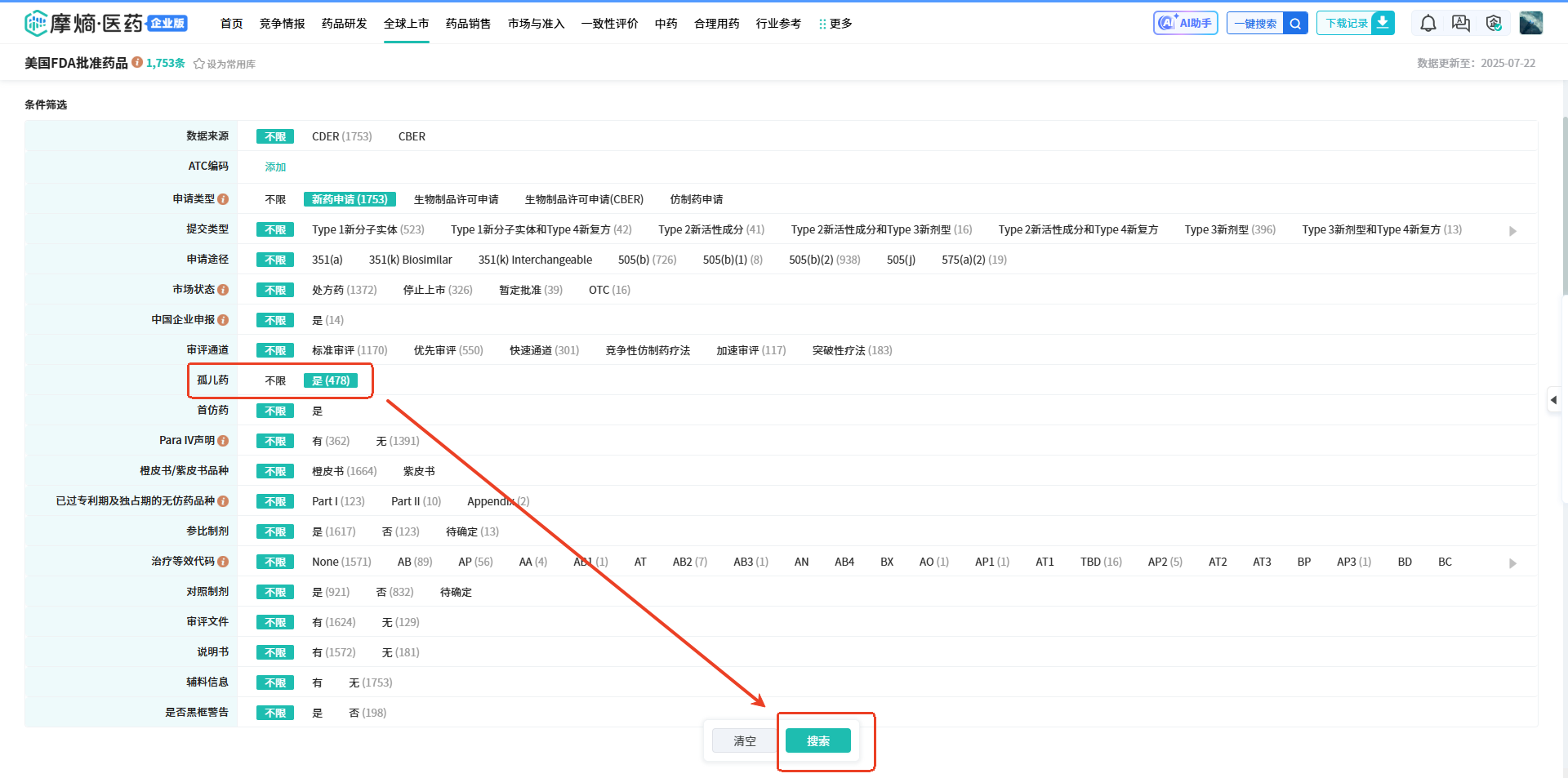

 (2)查询结果页面点击【按申报企业浏览】,可以看到涉及176家企业。
(2)查询结果页面点击【按申报企业浏览】,可以看到涉及176家企业。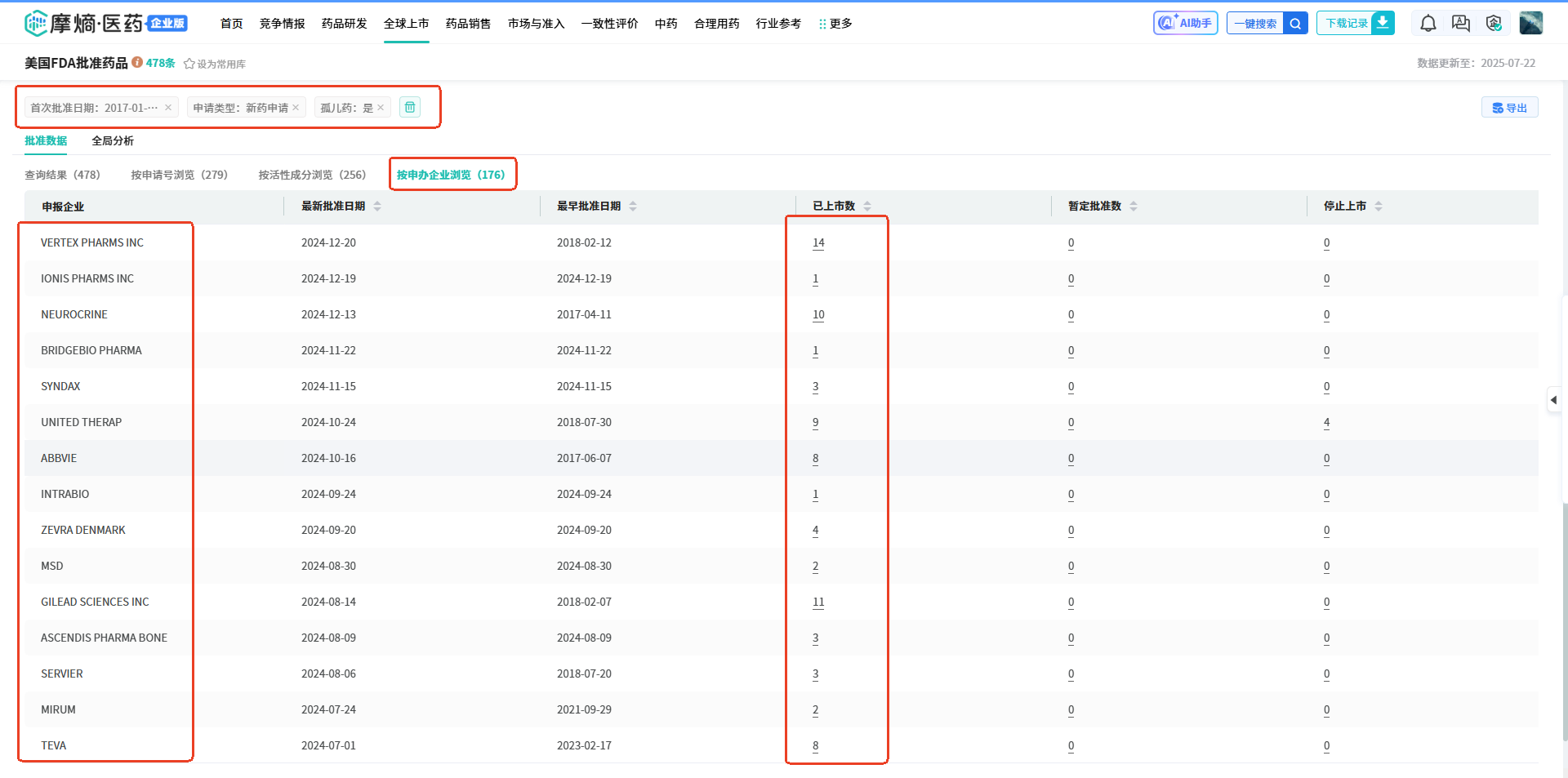 (3)查询结果页面点击【全局分析】,分析维度选择【申报】和【活性成分】,可以清晰看到全球企业2017-2024年期间在FDA批准上市的新药中的申报企业、活性成分数据。
(3)查询结果页面点击【全局分析】,分析维度选择【申报】和【活性成分】,可以清晰看到全球企业2017-2024年期间在FDA批准上市的新药中的申报企业、活性成分数据。 4.查询FDA历年批准的Type 1新分子实体,分析其申报企业、活性成分
4.查询FDA历年批准的Type 1新分子实体,分析其申报企业、活性成分
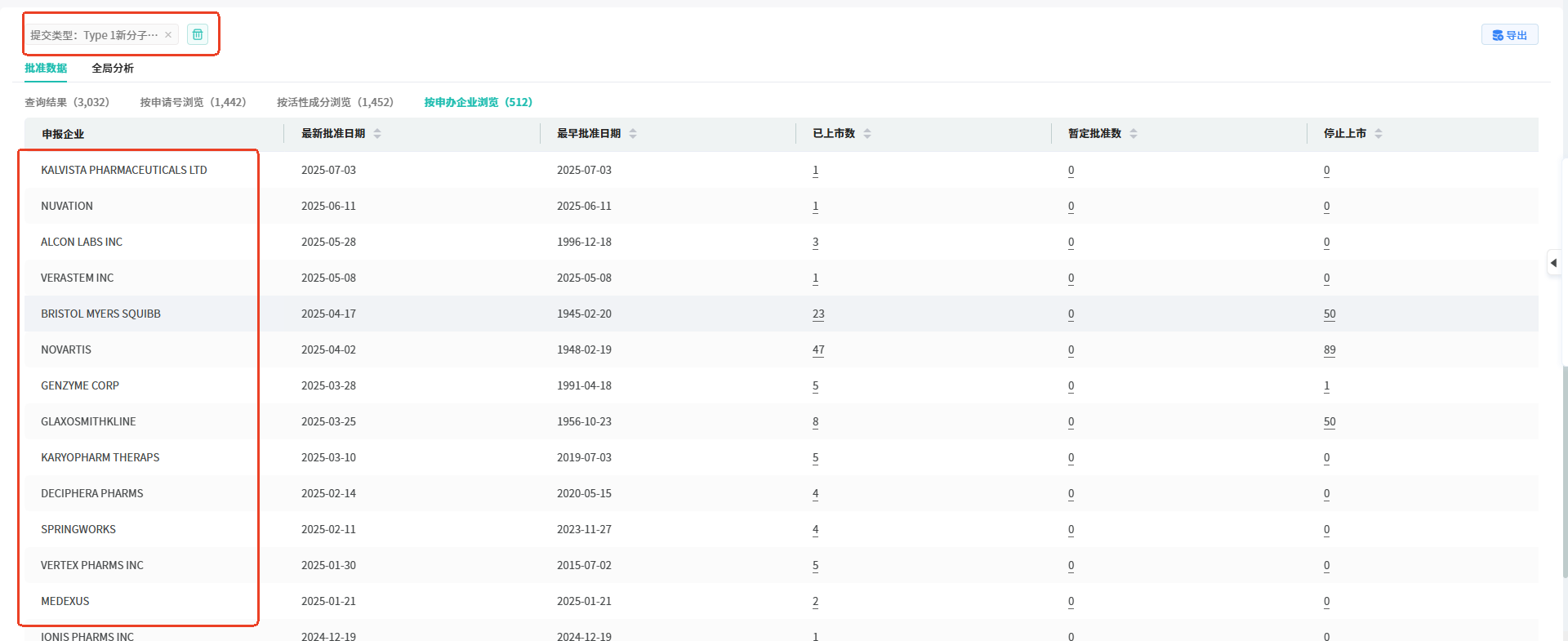
操作路径:【提交类型】选择【Type 1新分子实体】,然后点击搜索,就可以看到从1977年至2025年7月21日FDA批准的新分子实体共3032个,按申请号浏览为1442个,按活性成分浏览为1452个,按申办企业浏览为512个。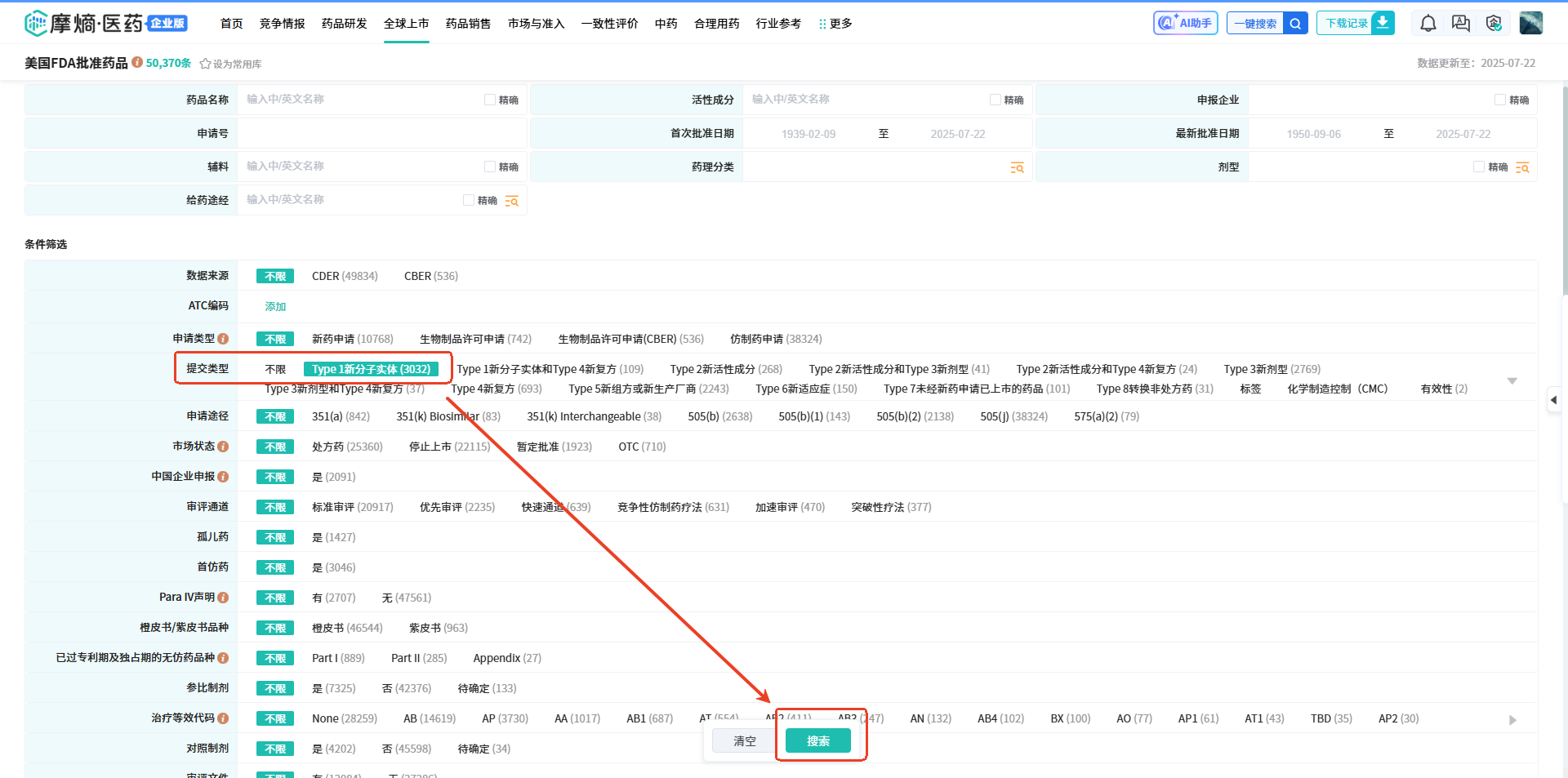
 在查询结果页面选择【全局分析】,可以看到不同分析维度的统计数据。从年度趋势维度分析,可以看到FDA批准的Type 1新分子实体数量在2020年达到峰值为77个,此后增长率一直上下波动;最高增长率为47.92%,最低负增长率为-29.41;在2024年FDA批准了85个新分子实体,相比2023年增长率为19.72%。
在查询结果页面选择【全局分析】,可以看到不同分析维度的统计数据。从年度趋势维度分析,可以看到FDA批准的Type 1新分子实体数量在2020年达到峰值为77个,此后增长率一直上下波动;最高增长率为47.92%,最低负增长率为-29.41;在2024年FDA批准了85个新分子实体,相比2023年增长率为19.72%。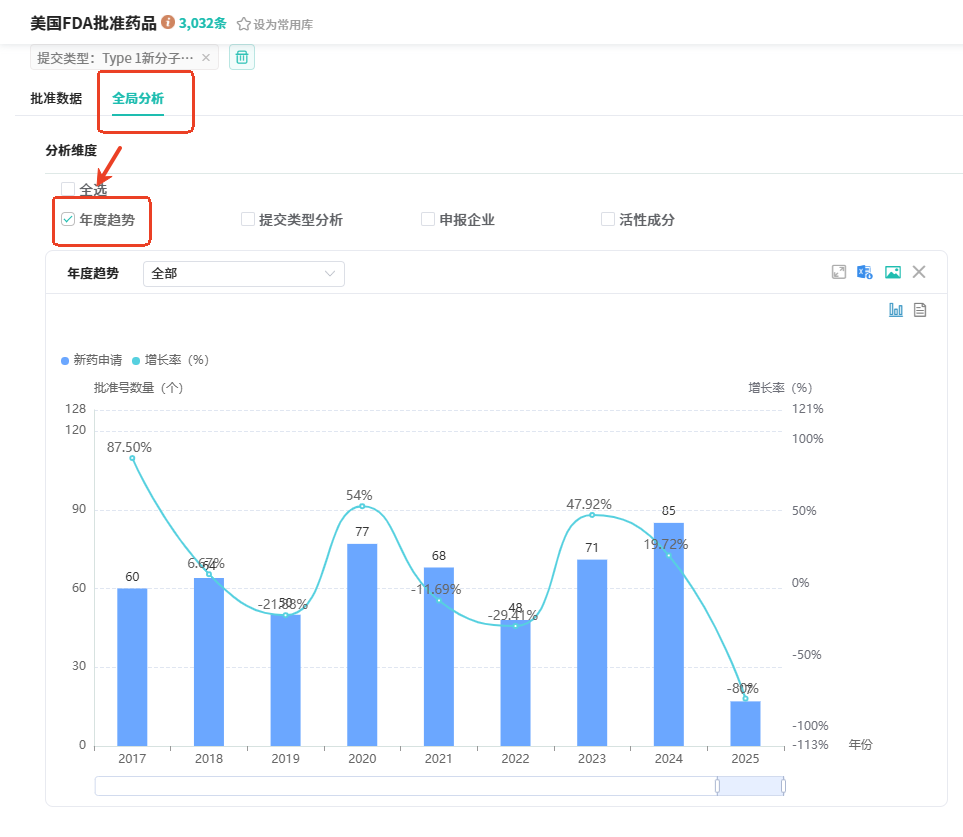 从活性成分和申报企业维度分析,可以看到FDA批准的Type 1新分子实体的活性成分、申报企业的TOP10/TOP50排名和其处方药/停止上市的药品数量;其中活性成分排名前五的有碘美普尔、盐酸罗哌卡因、华法林钠、达肝素钠、珀奈莫德;申报企业排名前三的有辉瑞(处方药77个,停止上市77个)、诺华(处方药49个,停止上市89个)、百时美施贵宝(处方药48个,停止上市634个)。
从活性成分和申报企业维度分析,可以看到FDA批准的Type 1新分子实体的活性成分、申报企业的TOP10/TOP50排名和其处方药/停止上市的药品数量;其中活性成分排名前五的有碘美普尔、盐酸罗哌卡因、华法林钠、达肝素钠、珀奈莫德;申报企业排名前三的有辉瑞(处方药77个,停止上市77个)、诺华(处方药49个,停止上市89个)、百时美施贵宝(处方药48个,停止上市634个)。 切换【数据视图】可以查看不同活性成分、申报企业处于不同市场状态的药品数量。
切换【数据视图】可以查看不同活性成分、申报企业处于不同市场状态的药品数量。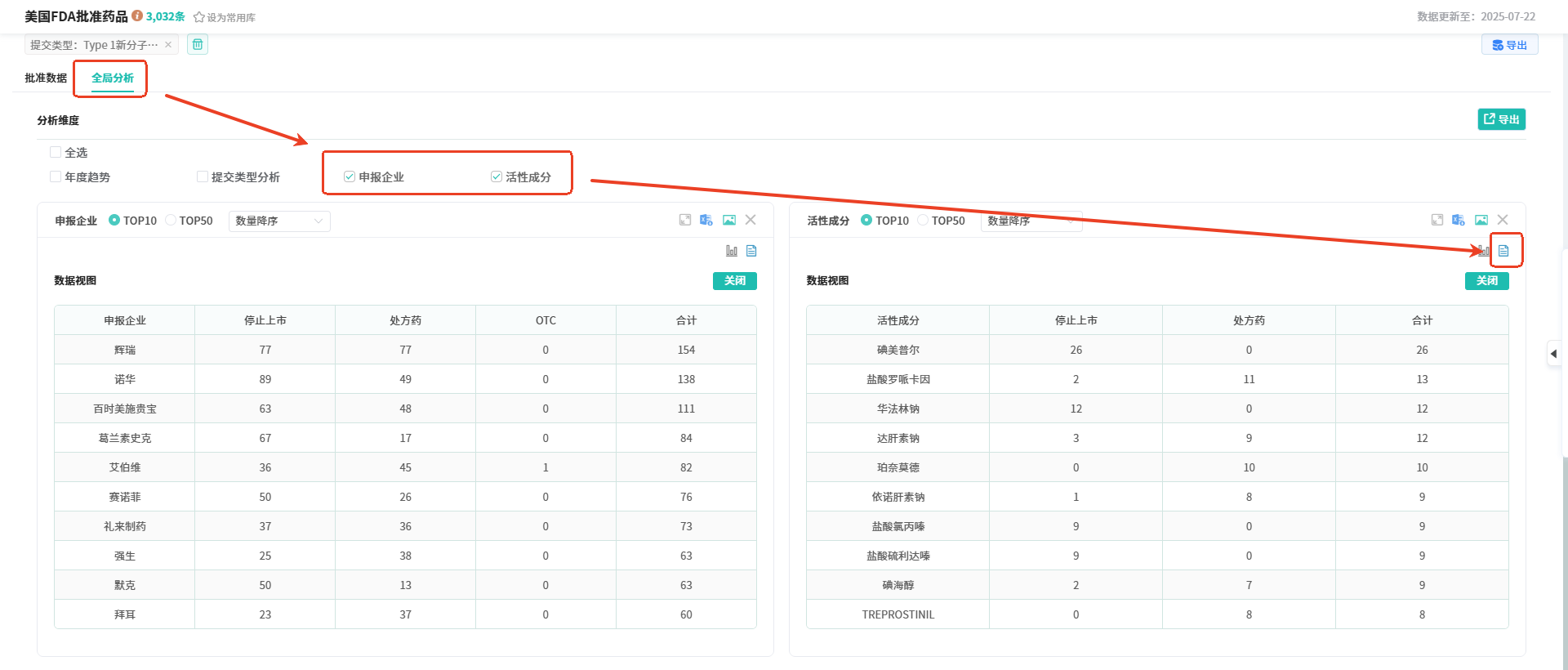 如上面解答未能解决您的问题,欢迎咨询【在线客服】进行反馈。
如上面解答未能解决您的问题,欢迎咨询【在线客服】进行反馈。
四、联系我们
1. 关注【摩熵医药】公众号,实时获悉医药行业前沿资讯,全球医药情报一手掌握!

2.申请试用美国FDA批准药品数据库:https://vip.pharnexcloud.com/?auto=1